
Theo dõi Báo Thanh tra trên

Nhóm PV
Thứ tư, 12/03/2025 - 21:46
(Thanh tra) - Báo Thanh tra đã có bài viết phản ánh việc Cục Quản lý Dược, Bộ Y tế nhiều lần có văn bản đình chỉ, thu hồi các dòng sản phẩm mỹ phẩm Obagi có chất cấm và sự tự nguyện thu hồi của đơn vị phân phối các sản phẩm này. Đáng tiếc, mới đây chúng tôi phát hiện các sản phẩm này lại được chính Cục Quản lý Dược cấp phép "lại", trong đó có cả sản phẩm có chất cấm.
Cục Quản lý Dược ban hành hàng loạt văn bản đình chỉ, thu hồi nhiều sản phẩm Obagi
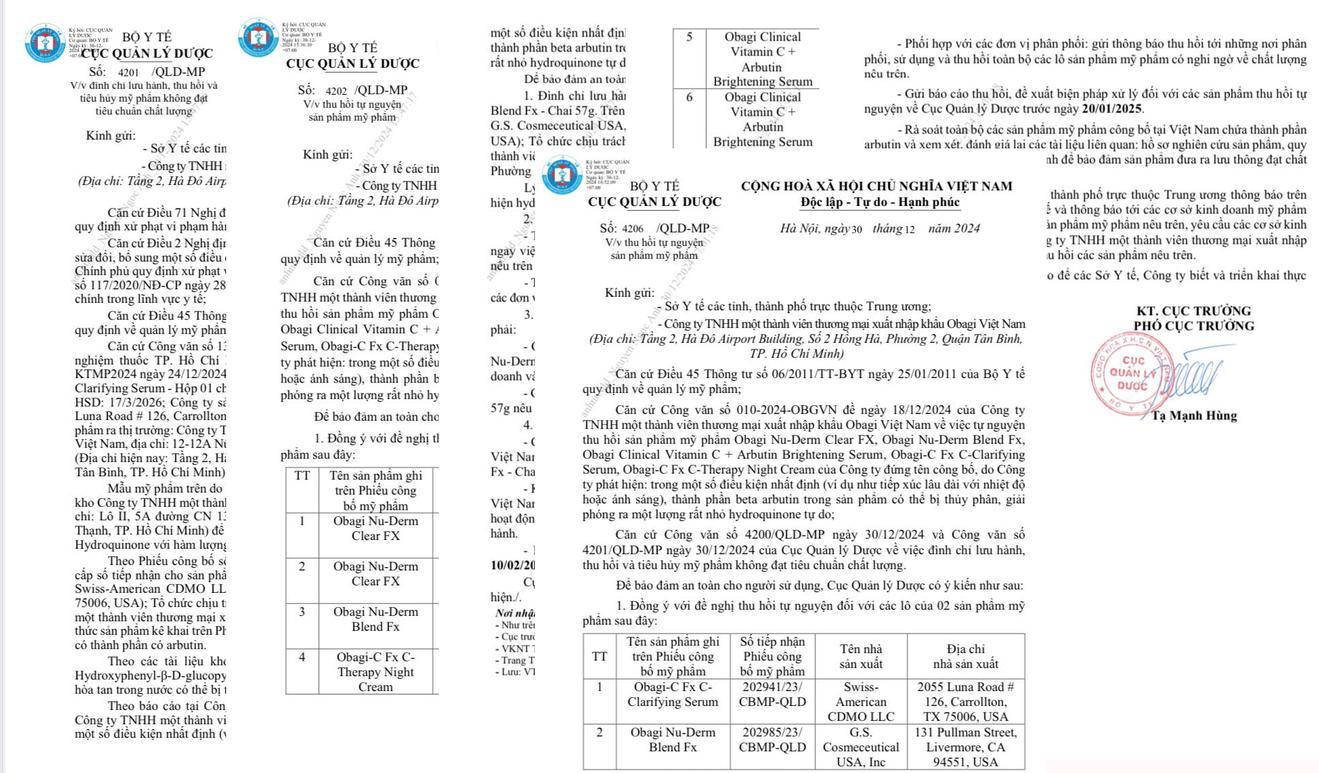
Tại bài viết trước, chúng tôi đã đề cập đến việc Cục Quản lý Dược ra văn bản đình chỉ, thu hồi nhiều sản phầm mỹ phẩm Obagi như: Obagi Nu-Derm Blend Fx; Obagi-C Fx C- Clarifying Serum. Lý do thu hồi: Phát hiện hydroquinone. Đây là sản phẩm do Cty TNHH MTV Thương mại xuất nhập khẩu Obagi Việt Nam, 12-12A Núi Thành, Phường 13, quận Tân Bình, TP Hồ Chí Minh (nay là tầng 2 Hà Đô Airport Building, số 2 Hồng Hà, Phường 2, quận Tân Bình, TP Hồ Chí Minh) chịu trách nhiệm đưa ra thị trường.
Bên cạnh đó, Cục Quản lý Dược đồng ý với đề nghị tự nguyện thu hồi 6 sản phẩm Obagi của Cty TNHH MTV Thương mại xuất nhập khẩu Obagi Việt Nam gồm: Obagi Nu-Derm Clear FX, số tiếp nhận Phiếu công bố mỹ phẩm 202947/23/CBMP-QLD, tên nhà sản xuất G.S Cosmeceutical USA, Inc, địa chỉ 131 Pullman Street, Livermore, CA 94551, USA; Obagi Nu-Derm Clear FX, số tiếp nhận Phiếu công bố mỹ phẩm 202946/23/CBMP-QLD, tên nhà sản xuất Swis-American CDMO LLC, địa chỉ 2055 Luna Road # 126, Carrollton, TX 75006, USA; Obagi Nu-Derm Blend FX, số tiếp nhận Phiếu công bố mỹ phẩm 202986/23/CBMP-QLD, tên nhà sản xuất Swis-American CDMO LLC, địa chỉ 2055 Luna Road # 126, Carrollton, TX 75006, USA; Obagi-C Fx C-Therapy Nighk Cream, số tiếp nhận Phiếu công bố mỹ phẩm 204500/23/CBMP-QLD, tên nhà sản xuất Swis-American CDMO LLC, địa chỉ 2055 Luna Road # 126, Carrollton, TX 75006, USA; Obagi Climical Vitamin C+ Arbutin Brightening Serum, số tiếp nhận Phiếu công bố mỹ phẩm 204483/23/CBMP-QLD, tên nhà sản xuất: Swis-American CDMO LLC, địa chỉ 2055 Luna Road # 126, Carrollton, TX 75006, USA; Obagi Climical Vitamin C+ Arbutin Brightening Serum, số tiếp nhận Phiếu công bố mỹ phẩm 202961/23/CBMP-QLD, tên nhà sản xuất: Swis-American CDMO LLC, địa chỉ 2055 Luna Road # 126, Carrollton, TX 75006, USA.
Ngoài ra, Cục Quản lý Dược gửi Sở Y tế các tỉnh, TP trực thuộc Trung ương; Cty TNHH MTV Thương mại xuất nhập khẩu Obagi Việt Nam thu hồi 2 sản phẩm khác không đạt tiêu chuẩn chất lượng là: Obagi-C Fx C- Clarifying Serum, số tiếp nhận Phiếu công bố mỹ phẩm 202941/23/CBMP-QLD, tên nhà sản xuất Swiss- American CDMO LLC, địa chỉ 2055 Luna Road # 126, Carrollton, TX 75006, USA và sản phẩm Obagi Nu-Derm Blend Fx, số tiếp nhận Phiếu công bố mỹ phẩm 202985/23/CBMP-QLD, tên nhà sản xuất G.S. Cosmeceutical USA, Inc, địa chỉ 131 Pullman Street, Livermore, CA 94551, USA. Đây là 2 sản phẩm phát hiện trong một số điều kiện nhất định (ví dụ tiếp xúc lâu dài với nhiệt độ hoặc ánh sáng), thành phần beta arbutin trong sản phẩm có thể bị thủy phân, giải phóng ra một lượng rất nhỏ hydroquinone tự do.
Cũng tại Quyết định số 858/QĐ-QLD ngày 24/12/2024, Cục Quản lý Dược đã đồng ý với đề nghị tự nguyện thu hồi 33 sản phẩm Obagi của Cty TNHH MTV Thương mại xuất nhập khẩu Obagi Việt Nam.
Văn bản của Cục Quản lý Dược gửi Báo Thanh tra cho biết, việc phân phối sản phẩm mỹ phẩm Obagi tiếp tục được nhà sản xuất ủy quyền thêm cho 1 đơn vị nữa là Công ty TNHH Waldencast Việt Nam (có địa chỉ tại Tòa nhà AB Tower, 76A đường Lê Lai, phường Bến Thành, Quận 1, Thành phố Hồ Chí Minh).
Theo tìm hiểu của chúng tôi, có tới hơn chục sản phẩm đã được thu hồi của Cty TNHH MTV Thương mại xuất nhập khẩu Obagi Việt Nam đã được Cục Quản lý dược cấp phép cho Công ty TNHH Waldencast Việt Nam mới đây.
Đơn cử: Sản phẩm Obagi Professional-c Peptide complex Serum số công bố 204610/23/CBMP-QLD cấp cho Cty TNHH MTV Thương mại xuất nhập khẩu Obagi Việt Nam ngày 28/6/2023, được cấp mới số 264739/25/CBMP-QLD ngày 24/01/2025 cho Công ty TNHH Waldencast Việt Nam. Sản phẩm Obagi Clinical Vitamin C + Arbutin Brightening Serum, số công bố 202961/23/CBMP-QLD ngày 2/6/2023 cho Cty TNHH MTV Thương mại xuất nhập khẩu Obagi Việt Nam, được cấp mới cho Công ty TNHH Waldencast Việt Nam số 258756/24/CBMP-QLD ngày 11/12/2024 cho Công ty TNHH Waldencast Việt Nam. Sản phẩm Obagi-C FX C-Clarifying Serum, số công bố 202941/23/CBMP-QLD ngày 2/6/2023 cấp cho Cty TNHH MTV Thương mại xuất nhập khẩu Obagi Việt Nam, được cấp mới cho Công ty TNHH Waldencast Việt Nam số 258753/24/CBMP-QLD ngày 11/12/2024. Sản phẩm Obagi Elastiderm Eye Cream, số cấp 202996/23/CBMP-QLD ngày 2/6/2023 cho Cty TNHH MTV Thương mại xuất nhập khẩu Obagi Việt Nam, được cấp mới cho Công ty TNHH Waldencast Việt Nam số 264740/25/CBMP-QLD ngày 24/1/2025…

Vitamin C+ Arbutin Brightening Serum là sản phẩm bị đình chỉ lưu hành mà vẫn được cấp phép lại
Đặc biệt, như chúng tôi đã nêu ở bài viết trước, 2 sản phẩm bị thu hồi là Obagi Climical Vitamin C+ Arbutin Brightening Serum và Obagi-C Fx C- Clarifying Serum là do có hàm lượng chất cấm hydroquinone thuộc Danh mục các chất không được phép sử dụng trong sản phẩm mỹ phấm chăm sóc da theo quy định tại Tham chiếu số 1339, Phụ lục II, Hiệp định mỹ phẩm ASEAN.
Còn nhớ, tại buổi làm việc với phóng viên Báo Thanh tra, Phó Cục trưởng Cục Quản lý Dược Tạ Mạnh Hùng khẳng định, khi phát hiện bất kỳ chất cấm nào trong các sản phẩm mỹ phẩm thì Cục Quản lý Dược cũng yêu cầu xử lý nghiêm. Về nguyên tắc, doanh nghiệp phải chịu trách nhiệm khi công bố về thành phẩn của sản phẩm; nếu phát hiện vi phạm trong công bố đưa sản phẩm ra thị trường của đơn vị phân phối sản phẩm Obagi thì đơn vị này còn phải chịu mức phạt với tình tiết tăng nặng… Tuy nhiên, chính đơn vị này lại cấp phép cho các sản phẩm đã được thu hồi, trong đó có các sản phẩm bị đình chỉ, thu hồi do phát hiện có hàm lượng chất cấm hydroquinone?
Theo ông Tạ Mạnh Hùng, Cục Quản lý Dược đã cho rà soát lại thì đúng là có việc cấp phép “lại” như trên, trong đó có 3 sản phẩm có chất cấm. Lý do là theo văn bản thỏa thuận 3 bên ngày 26/9/2024, Công ty Obagi Cosmeceuticals LLC (Mỹ) ủy quyền song song cho Công ty TNHH MTV Thương mại xuất nhập khẩu Obagi Việt Nam và Công ty Waldencast Việt Nam đồng thời được nhập khẩu, phân phối và công bố sản phẩm nhãn hàng Obagi Việt Nam. Theo thỏa thuận đó, ngày 6/11 và 13/11/2024, Công ty Waldencast Việt Nam đã nộp 49 hồ sơ công bố mỹ phẩm nhãn hàng Obagi. Trong khi đó, ngày 19/12/2024, Cục Quản lý Dược mới nhận được văn bản của Trung tâm Kiểm nghiệm quốc gia tại TP Hồ Chí Minh về việc đình chỉ lưu hành trên toàn quốc với sản phẩm Obagi-C Fx CClarifying Serum vì lý do mẫu kiểm nghiệm không đạt tiêu chuẩn chất lượng (có phát hiện hydroquinone với hàm lượng 0,027%); đình chỉ lưu hành trên toàn quốc với sản phẩm Obagi Nu-Derm Blend Fx cũng với lý do không đạt tiêu chuẩn chất lượng, phát hiện hydroquinone với hàm lượng 0,019%...
Phó Cục trưởng Cục Quản lý Dược cho biết, lãnh đạo Cục Quản lý Dược đã yêu cầu phòng chức năng có văn bản mời Công ty Obagi Hoa Kỳ và Công ty Waldencast Việt Nam đến làm việc trực tiếp, đề nghị cung cấp hồ sơ chi tiết các sản phẩm nói trên về thành phần và yếu tố thị trường đặc thù (có phải là sản phẩm dành riêng cho thị trường Việt Nam hay không); nếu xác định có hành vi gian dối trong hồ sơ hoặc gây ảnh hưởng đến sức khỏe người tiêu dùng sẽ xử lý nghiêm. Cục Quản lý Dược cũng sẽ tăng cường phối hợp với cơ quan quản lý thị trường và hải quan trong việc quản lý Nhà nước với các dòng mỹ phẩm, trong đó có Obagi.
Như vậy, liên quan đến việc cấp phép các sản phẩm mỹ phẩm Obagi vào thị trường Việt Nam đang tồn tại khá nhiều vấn đề cần làm rõ. Vì sao công ty mẹ và các đơn vị phân phối xin cấp phép ồ ạt các số tiếp nhận công bố mỹ phẩm ở Cục quản lý Dược rồi lại “tự nguyện thu hồi”? Vì sao các sản phẩm “có vết” vẫn được cấp phép đi cấp phép lại? Có gì ẩn khuất ở đây?
Chúng tôi sẽ tiếp tục trở lại vụ việc.
Ý kiến bình luận:
Hiện chưa có bình luận nào, hãy trở thành người đầu tiên bình luận cho bài biết này!

(Thanh tra) - Dù bản án phúc thẩm đã có hiệu lực pháp luật, quyền sử dụng đất hợp pháp đã được xác lập rõ ràng, nhưng đến nay, ông Trịnh Ngọc Lâm (trú tỉnh Đắk Lắk) vẫn chưa thể nhận lại phần đất của mình. Quá trình thi hành án kéo dài, nhiều lần bị “đứng lại”, khiến người thắng kiện rơi vào cảnh mòn mỏi chờ công lý được thực thi.
Thuỳ Anh

(Thanh tra) - Ngày 21/12, Công an tỉnh Thanh Hoá thông tin, Cơ quan Cảnh sát điều tra - Công an Thanh Hóa đã điều tra, làm rõ vụ "người chết" cách đây 5 năm, bỗng sống lại. Quá trình điều tra, xác minh, bằng các biện pháp nghiệp vụ và tinh thần tấn công trấn áp quyết liệt đối với tội phạm, lực lượng công an đã thu thập đầy đủ tài liệu, chứng cứ, buộc Nguyễn Thị Thu phải cúi đầu nhận tội và khai nhận hành vi “giả chết” của mình để trục lợi bảo hiểm tại phường Quang, tỉnh Thanh Hoá.
Hương Trà
Trọng Tài
Lê Hữu Chính
Hữu Anh

Cảnh Nhật

Hương Giang

Lan Anh

Minh Nguyệt


Hương Giang

Huỳnh Như

Bình Yên

Hương Giang

Hải Hà

B.S

B.S